Поняття про електронегативність. Електронна природа хімічного зв'язку. Типи хімічного зв'язку. Полярний і неполярний ковалентний зв'язок
Автор: вчитель хімії КЗ «Спеціалізована школа з поглибленим вивченням іноземних мов І ступеня - гімназії № 11 м. Дніпродзержинська» (Кам'янське) Гавриліна Вікторія Вікторівна, вчитель вищої категорії, педагогічне звання «методист».Мета уроку:
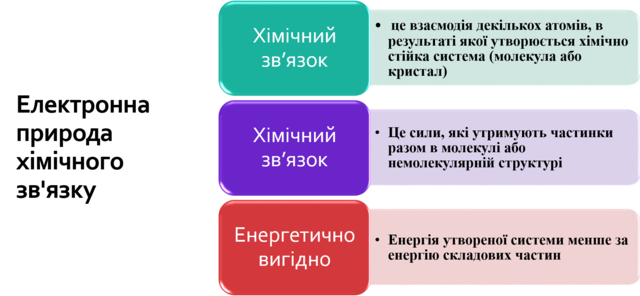
- сформувати уявлення про ковалентний зв’язок;
- охарактеризувати механізм утворення ковалентного зв’язку;
- пояснити сутність формування спільних електронних пар;
- формувати навички складання електронних і структурних формул речовин із ковалентним типом зв’язку,
- продовжувати формувати уміння аналізувати, порівнювати, робити висновки.
1.Що називають валентними електронами?
2.Дайте визначення валентності.
3.Як визначити максимальну валентність елемента?
4. Як за положення в Періодичній системі визначити число спарених та неспарених електронів елемента?
Найелектронегативнішим є Флуор.
В періодах із збільшенням порядкового номера електронегативність збільшується, а в групах зменшується.

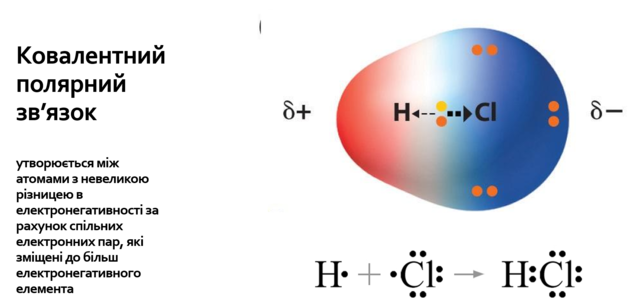
Структурна формула гідроген хлориду:
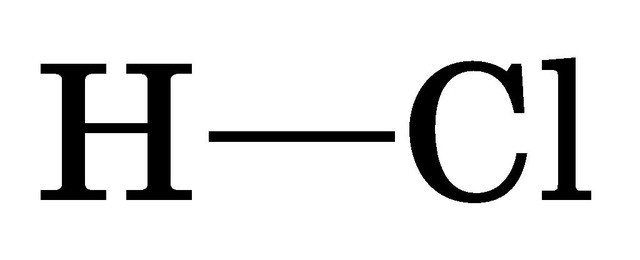
1.Визначте число електронів на зовнішньому енергетичному рівні.
2.Визначте число зовнішніх неспарених електронів.
3.Визначте число загальних (зв’язувальних) електронних пар.
4.Запишіть схему хімічного зв’язку.
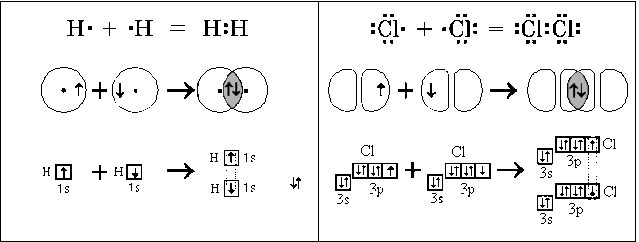
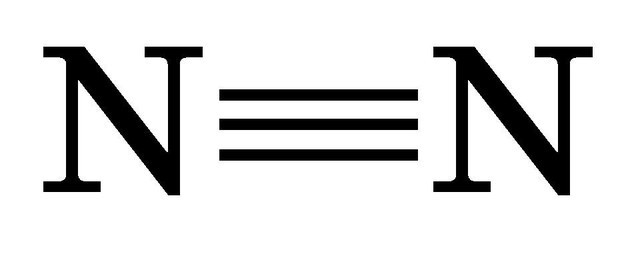
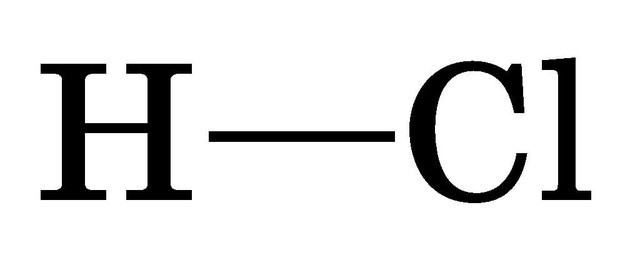
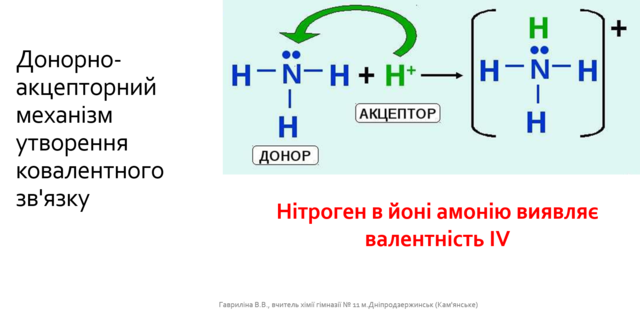
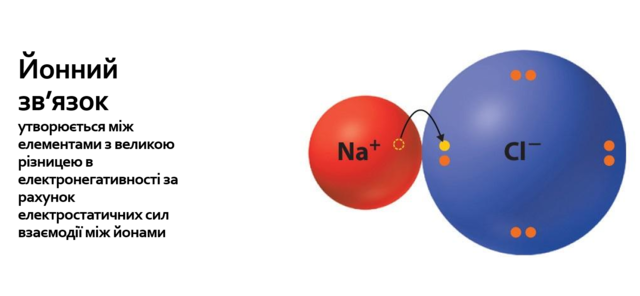
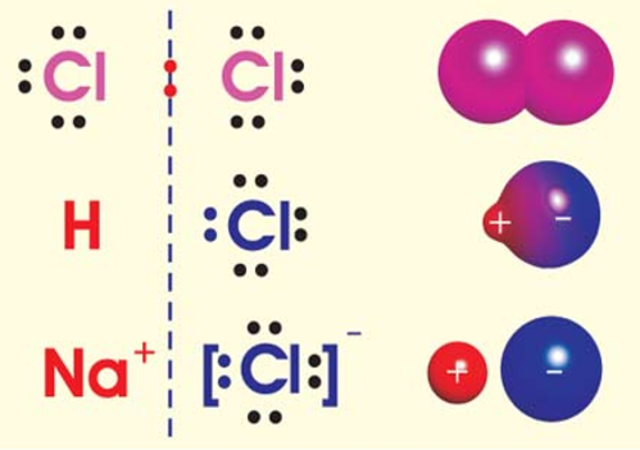
Проаналізуйте залежність хімічного зв'язку від електронегативності:
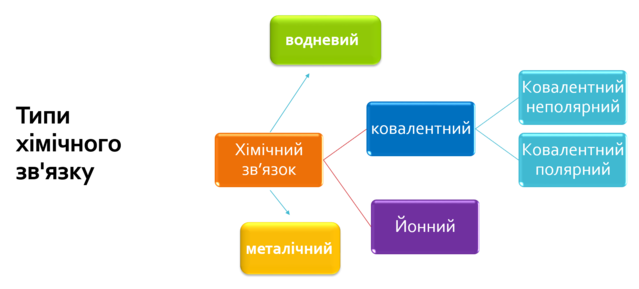
1.Із наведеного переліку випишіть формули речовин з ковалентними зв’язками: NH3, CO2, Al, KOH, NaF, O2, Br2, SO3
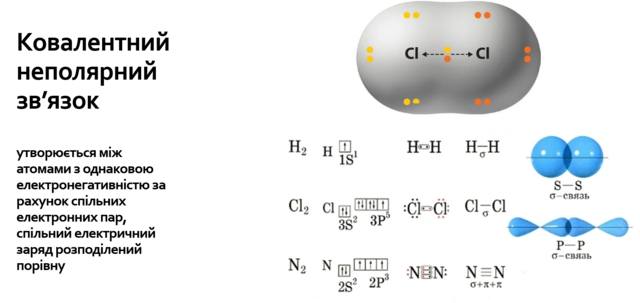
2. Розгляньте приклади утворення електронно-крапкових формул речовин із ковалентним неполярним зв'язком.

Складіть електронно-крапкові та структурні формули гідроген броміду, води, гідроген сульфіду, хлору.
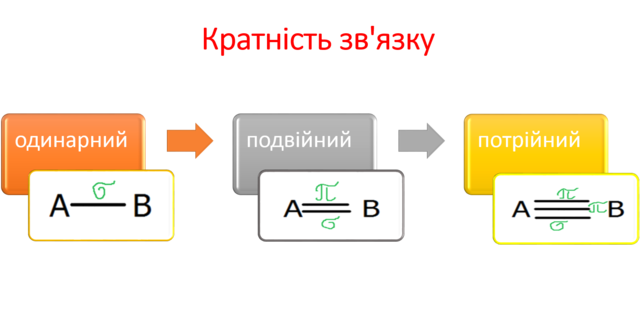
3.Наведіть приклади молекул, у яких зв’язок здійснюється однією, двома, трьома парами електронів.
Виконайте завдання за посиланням:
http://goo.gl/forms/ht9wv9fl1AbN1iFo1