Валентність та ступінь окиснення елементів.
Автор: вчитель хімії КЗ «Спеціалізована школа з поглибленим вивченням іноземних мов І ступеня - гімназії № 11 м. Дніпродзержинська» (Кам'янське) Гавриліна Вікторія Вікторівна, вчитель вищої категорії, педагогічне звання - методист.
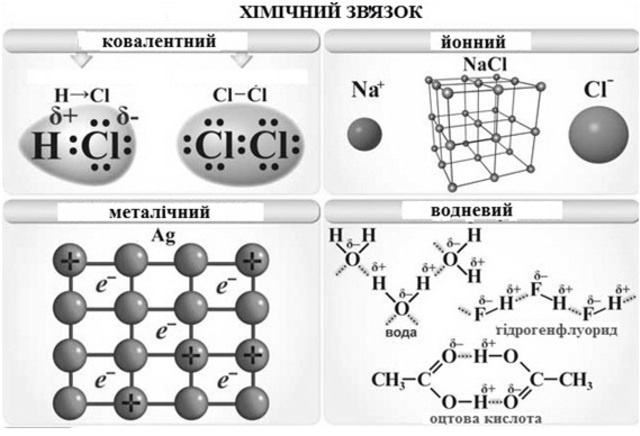
- Сума ступенів окиснення елементів в складній речовині дорівнює нулю.
- Якщо сполука є бінарною, то один з елементів має позитивний ступінь окиснення, а інший — негативний. Так, у більшості сполук Гідроген має ступінь окиснення +1, а Оксиген — –2.
- А як дізнатися, який елемент у сполуці виявляє позитивний ступінь окиснення, а який — негативний?
- Для цього потрібно звернутися до ряду електронегативності хімічних елементів:
- У бінарних сполуках хімічний елемент, що стоїть у цьому ряду лівіше, виявляє негативний ступінь окиснення, а той, що стоїть правіше,— позитивний. Так, у сполуці MgO хімічний елемент Магній має позитивний ступінь окиснення +2, а Оксиген — негативний ступінь окиснення –2.
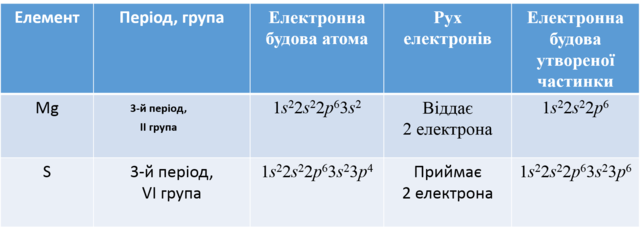
- Позитивні значення ступенів окиснення мають ті атоми, які віддали свої електрони іншим атомам (спільна електронна хмара зміщена від них). Це, наприклад, атоми металів.
- Негативні значення ступенів окиснення мають ті атоми, які приєднали електрони від інших атомів (спільна електронна хмара зміщена до них).
- Негативне значення ступеня окиснення –1 завжди має Флуор у всіх сполуках.
- Металічні елементи, навпаки, не можуть мати негативні значення ступенів окиснення. Вони завжди набувають додатніх значень, тому що через великий радіус атома віддають свої валентні електрони, при цьому отримують "октет" попереднього енергетичного рівня.
- Найменше значення ступеня окиснення неметалічних елементів розраховують за формулою "номер групи - вісім" (це максимальне число електронів, яке може прийняти атом до завершення октету).
- Найвищу ступінь окиснення визначають за номером групи (скільки всьго може віддіти валентних електронів).
- Нульове значення ступенів окиснення мають атоми в простих речовинах, наприклад Сl2, O2.
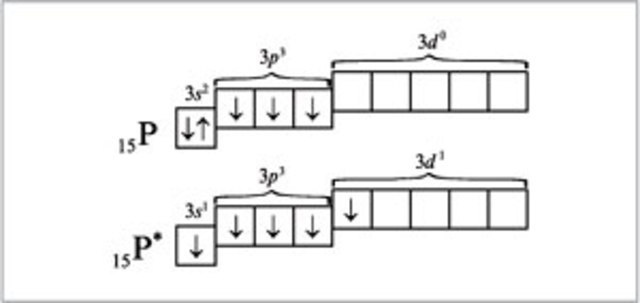
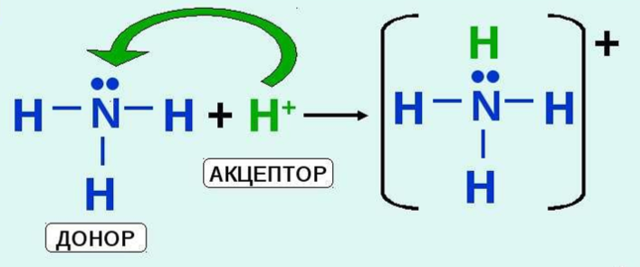
(Завдання 1-6 оцінюються в 0,5 бала).
| Завдання з вибором однієї правильної відповіді (1-5) містять формулювання завдання та чотири варіанти відповідей до нього. Серед наведених варіантів відповідей тільки одна є правильною. Ви маєте вибрати правильну відповідь і букву, якій вона відповідає. |
1. Неметалічні властивості елементів збільшуються в ряді:
А) F, O, N, C; Б) I, Br, Cl, F; В) C, Si, Ge, Pb.
2. Тип зв'язку в молекулі NH3:
А) йонний; В) ковалентний неполярний;
Б) металевий; Г) ковалентний полярний.
3. Атом якого елемента легко віддає валентні електрони:
А) S; Б) Na; В) F; Г) O.
4. Виберіть тип хімічного зв’язку, який утворюється між атомами елементів-неметалів з однаковою електронегативність:
А) ковалентний неполярний; В) йонний;
Б) ковалентний полярний; Г) металевий.
5. Укажіть сполуки в який хлор виявляє ступінь окиснення +1:
А) HCl; Б) HClO; В) HClO4; Г) HClO3;
6. Впишіть пропущене слово:
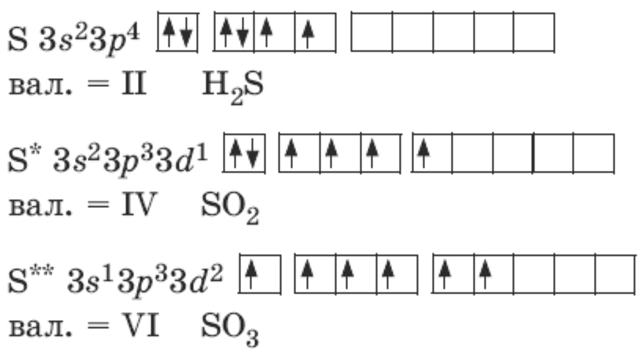
……......визначається числом хімічних зв'язків, якими даний атом з'єднаний з іншими атомами в сполуці.
(Завдання 7-9 оцінюються в 1 бал).
| Завдання 7 на встановлення відповідності містять формулювання завдання та дві колонки. В одній колонці містяться певні завдання, до яких потрібно підібрати правильні відповіді з іншої колонки. Ви маєте пам’ятати, що одному пункту колонки 1 відповідає тільки один пункт колонки 2. Пункти не повторюються. |
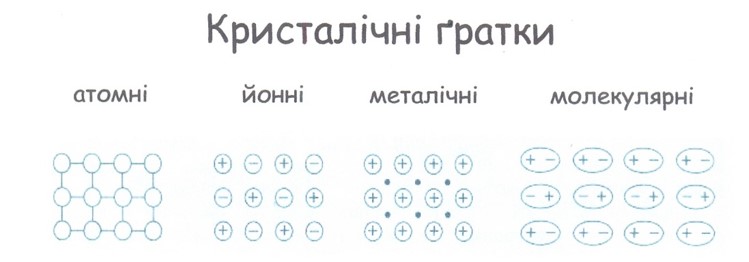
7. Установіть відповідність між формулою речовини та типом кристалічної ґратки :
кристалічні ґратки речовини:
А) йонна; 1) Na;
Б) атомна; 2) CH4;
В) молекулярна; 3) KBr;
Г) металічна; 4) ) алмаз.
| Завдання 8 на правильну послідовність містить формулювання завдання та варіанти певних дій, понять формул, характеристик. Наведені дії, поняття, формули, характеристики треба розташувати в певній послідовності. Ви маєте пам’ятати, що першій дії (поняттю, формулі, характеристиці) відповідає цифра 1, другій – цифра 2. |
8. Розташуєте сполуки по зростанню ступеня окиснення Мангану:
А) KMnO4; Б) MnO2; В) MnCl2; Г) K2MnO4.
| Завдання 9-12 відкритої форми |
9. Складіть електронно-крапкову формулу молекули кисню.
(Завдання 10-11 оцінюються в 1.5 бали).
10. Гра в «Хрестики і нулики». Виграшний шлях: сполуки, що мають однакове значення ступеня окиснення Нітрогену.
| KNO3 | Mg3N2 | NH3 |
| KNO2 | N2O3 | NaNO2 |
| N2 | HNO3 | NaNO3 |
11. Визначите ступені окиснення елементів у сполуках: Cu2O, NaOH, H2SiO3, Ba(NO3)2, Zn.
(Завдання 12 оцінюється в 3 бали).
12. Визначите тип хімічного зв’язку в сполуках: H2, РН3, KBr, Cu, МgО.шнє завдання